Gli elementi chimici presenti in natura sono 92 quelli e alcuni li conosciamo bene: l’oro dei gioielli, l’ossigeno che respiriamo, il mercurio dei vecchi termometri. Dalle loro numerose combinazioni si forma tutta la materia che conosciamo al mondo (a parte quella oscura): cloro e sodio formano il sale da cucina, idrogeno e ossigeno l’acqua che beviamo, carbonio e idrogeno il gas metano che alimenta la caldaia di casa.
I composti chimici
I composti chimici hanno proprietà chimiche e fisiche (il peso molecolare, lo stato fisico, il punto di fusione o di ebollizione) completamente diverse da quelle degli elementi di partenza. Il frammento più piccolo che può esistere di un composto, e che mantiene queste caratteristiche non è più un atomo ma una molecola. Facciamo un esempio: l’acqua è un composto chimico formato dalla combinazione di due elementi, l’ossigeno e l’idrogeno, che in natura, alle temperature che si possono misurare sulla terra, si trovano allo stato gassoso. Un atomo di ossigeno si combina con due atomi di idrogeno per formare una molecola di acqua, la cui formula chimica perciò si scrive H2O. Non parliamo quindi di atomo di acqua ma di molecola perché l’acqua non è un elemento ma un composto. L’acqua in natura si può trovare in tutti gli stati fisici possibili, solida al di sotto di 0 gradi Celsius (il ghiaccio), liquida fra 0 e 100 gradi e gassosa sopra a 100 gradi (vapore acqueo) quindi le sue caratteristiche sono molto diverse da quelle dei due gas da cui è formata. Il peso di una molecola di acqua sarà esattamente la somma dei pesi atomici degli elementi di cui è formata, 16 quello dell’ossigeno e 2 (2×1) quello dei due atomi di idrogeno, quindi 18. In questo caso parliamo di peso molecolare dell’acqua. L’unità di misura in cui esprimiamo i pesi di atomi e molecole è l’UMA, unità di massa atomica.
La mole
Ma quanto pesa un atomo di idrogeno in grammi?
La risposta è 0,00000000000000000000000167328 grammi che, per abbreviare, usando quella che si chiama “notazione scientifica” si scrive 1,67328×10-24 grammi (e si legge 1,67328 per dieci alla meno 24).
Certo pesare una simile quantità in laboratorio è impossibile, quindi i chimici per facilitarsi il lavoro si sono inventati un’unità di misura che si chiama mole. La mole è la quantità di un elemento o di un composto chimico che contiene il peso atomico o molecolare espresso in grammi. Quindi una mole di Ossigeno che pesa 16 grammi, e due moli di idrogeno che pesano 2 grammi si combinano per dare una mole di acqua che peserà 18 grammi. Queste sono quantità che si possono tranquillamente misurare in un laboratorio.
Il risultato del rapporto fra un grammo di idrogeno e il peso in grammi di un atomo di idrogeno sarà lo stesso del rapporto fra il peso di 18 grammi di acqua e il peso in grammi di una molecola d’acqua; quindi, una mole per definizione conterrà sempre lo stesso numero di elementi, e questo numero è esattamente 602.214.076.000.000.000.000.000 detto numero di Avogadro che con la notazione scientifica si scrive 6,02214076×1023 (e si legge 6,02214076 per dieci alla 23).
Possiamo immaginare una mole di qualsiasi cosa, una mole di panini, una mole di sedie, una mole di libri…
I legami ionici e covalenti
Ma cosa tiene insieme queste “combinazioni”? Un’attrazione fra gli atomi che chiameremo il legame chimico. Esistono diversi tipi di legami, che dipendono dalle proprietà degli atomi, che a loro volta sono determinate dalla loro posizione nella tavola periodica degli elementi.
Sappiamo che gli atomi tendono ad essere stabili se hanno 8 elettroni nell’orbitale più esterno (l’ottetto) (vedi l’articolo Ma perché non siamo in otto? Inlibertà). Infatti, gli elementi dell’ultimo gruppo che hanno 8 elettroni nel livello più esterno sono stabili e non reattivi, mentre gli elementi che hanno da 5 a 7 elettroni esterni tenderanno a procurarsi gli elettroni mancanti “strappandoli” agli elementi che ne hanno da 1 a 4. Questa tendenza a procurarsi elettroni si chiama elettronegatività, ed è una caratteristica molto spiccata degli elementi del penultimo gruppo.
Elementi con elevata elettronegatività tenderanno a reagire con elementi con bassa elettronegatività (quelli del primo gruppo) per dare composti che vengono definiti ionici. Questo perché l’elemento che “perde” un elettrone (che ha carica negativa) formerà uno ione positivo (o catione) mentre l’elemento che lo acquista assumerà una carica negativa diventando ione negativo (anione).
Ioni negativi e ioni positivi sono soggetti ad una attrazione elettrostatica, formando composti tenuti insieme da un tipo di legame detto ionico. Questi composti in genere hanno una struttura solida cristallina, si sciolgono facilmente in acqua e poiché il legame è forte hanno punti di fusione elevati. Il cloruro di sodio (sale da cucina) formato da un elemento del primo gruppo (il sodio) e uno del penultimo, il cloro, ne è un tipico esempio.
Quando invece l’elettronegatività fra gli atomi non è così diversa gli elettroni vengono condivisi, “messi in comune”, per formare composti tenuti insieme da legami detti covalenti. Ad esempio, nella molecola di acqua l’ossigeno che ha sei elettroni nell’ orbitale più esterno e i due atomi di idrogeno che ne hanno uno ciascuno, condividono gli otto elettroni in un orbitale “molecolare” che li tiene uniti nella formula H=O=H.
Il legame metallico
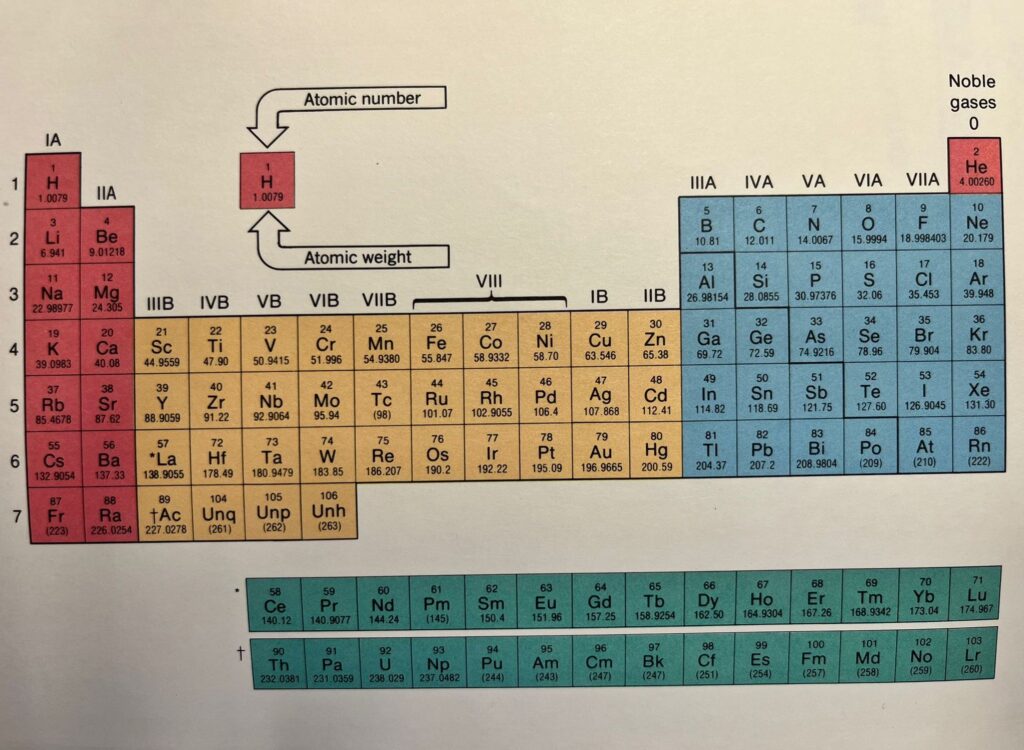
Se guardiamo una tavola periodica degli elementi ci accorgeremo che fra le prime due colonne e le ultime sei, quelle che contengono i gruppi che hanno da tre a otto elettroni esterni, a partire dal quarto periodo (la quarta riga), c’è un nutrito gruppo di elementi di cui non abbiamo ancora parlato. Si tratta di circa 40 elementi detti metalli di transizione, divisi in 10 gruppi e 4 periodi, fra i quali alcuni che ci sono molto familiari come Ferro, Rame, Zinco, Mercurio, Oro e Platino e altri dai nomi più esotici come Osmio, Iridio, Tallio. Questi elementi corrispondono al riempimento progressivo, a partire dal terzo livello, dopo l’orbitale 3s e i tre orbitali 3p, degli orbitali di tipo d, che sono cinque, e quindi sfuggono alla regola dell’ottetto, in quanto il livello sarà completo solo con dieci elettroni.
Gli elementi di transizione tendono ad avere proprietà particolari, dovute soprattutto alla capacità dell’orbitale d di formare una nube di elettroni che tiene insieme molti atomi dello stesso elemento, conferendo al composto le proprietà tipiche dei metalli come la lucentezza, la malleabilità, la capacità di condurre la corrente elettrica: più sono gli elettroni condivisi tra i nuclei, migliori sono le caratteristiche meccaniche del metallo. Questo è il legame metallico.
*Biochimico, direttrice del dipartimento di medicina epidemiologia e igiene del lavoro ed ambientale dell’INAIL
Foto dell’autore


Scrivi